溶液 の 質量 の 求め 方 溶液 の 質量 の 求め 方4番教えてください 計算の仕方がわからないです Clear 危険物資格取得のための高校化学no 1 濃度計算 新たな学びをデザインする教育フリーランス 溶液の性質 飽和溶液を冷却したときの結晶の析出量の計算方法を教えてください 化学 定期は質量モル濃度にほぼ比例するから,沸点 上昇度 も質量 濃度 1mol/kg のときの沸点上昇度に相当するが,希薄溶液の測定値から求め たも ので,実際の 1mol/kg の値ではない。 純溶媒の沸点とモル沸点上昇 K b 溶 媒 沸点〔 ℃ 〕 K b 溶 媒 沸点〔 ℃ 〕 K b 水 0515 ギたとえば「全体の50%」は「100に対して50」、半分ってコトですね。 溶質を求める問題に関しては方程式を使うより、この方法のほうが意味がわかりやすいかもしれません。 「全体×割合」はほかでも使いやすい方法です。 例題2を解いてみましょう。 水溶液全体は0g、その10%が溶質(食塩)となるので、 答えはg になります。
溶液の質量パーセント濃度の求め方と比重を利用した計算問題
溶液の質量の求め方
溶液の質量の求め方- ① 溶液1Lの質量を求める 1L=1000cm 3 であり、ので、 1000× 18 = 1800g ② 溶質の質量を求める ①で求めた溶液の質量は1800gであり、そのうち98%が溶質(この問題の場合は硫酸)です。 溶質の質量は、①で求めた溶液の質量×パーセント濃度/100で求め ホーム » 理科 » 化学 » 「濃度」の計算が苦手な方へ! 元研究員がわかりやすく解説 問題1 質量パーセント濃度15%の水酸化ナトリウム(NaOH)溶液の密度は10g /cm3 です。 この水溶液のモル濃度を求めましょう。 ただし、原子量 H=10 O=16 Na=23 とします



化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム
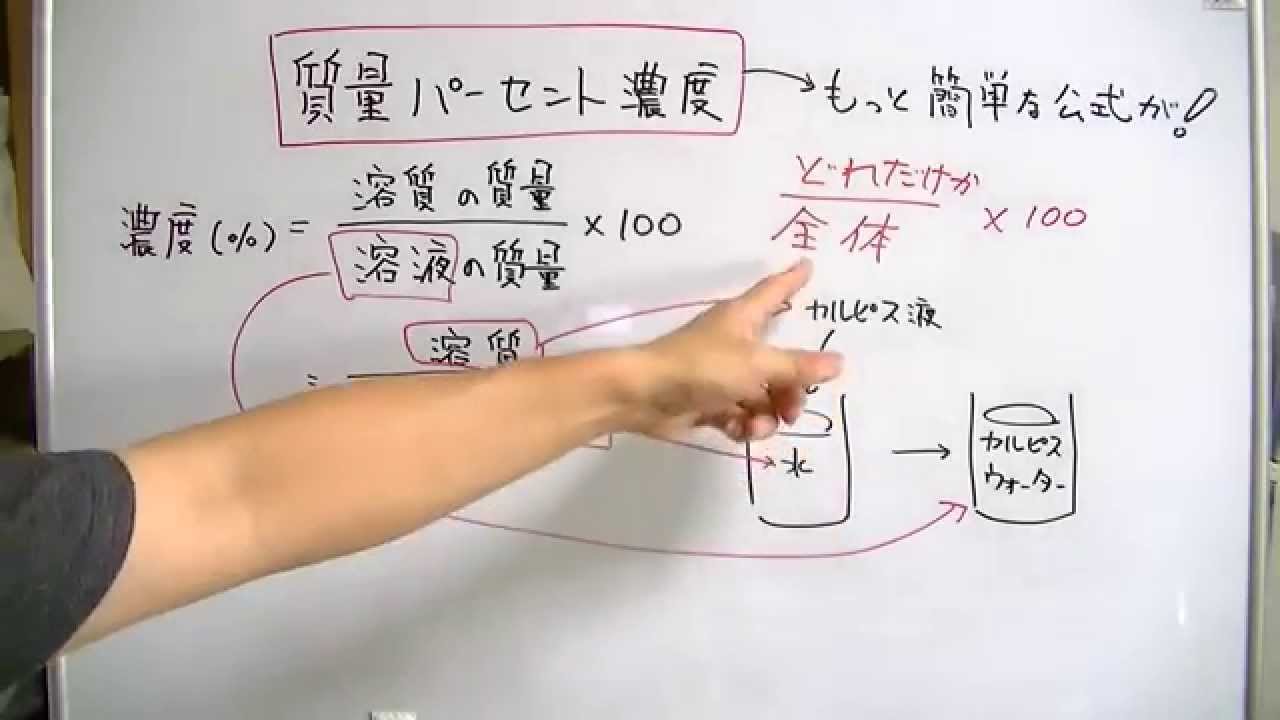
①溶液の質量パーセン 質量パーセント濃度 公式 覚え方 質量パーセント濃度を計算する問題を出してほしい! = (溶質の質量)÷(溶液の質量)×100 = (アクエリアスの粉の質量)÷(アクエリアスの質量)×100 = 48 ÷ 1048 ×100 ≒ 458% になるね! 計算結果から、 質量パーセント濃度は458%ってことがわかった。溶液100 g 中に含まれる溶質の質量(g )をパーセントで表したもの。 溶質の質量をW、溶媒の質量をW s とすると (w/w)% =(W/(W s +W))×100
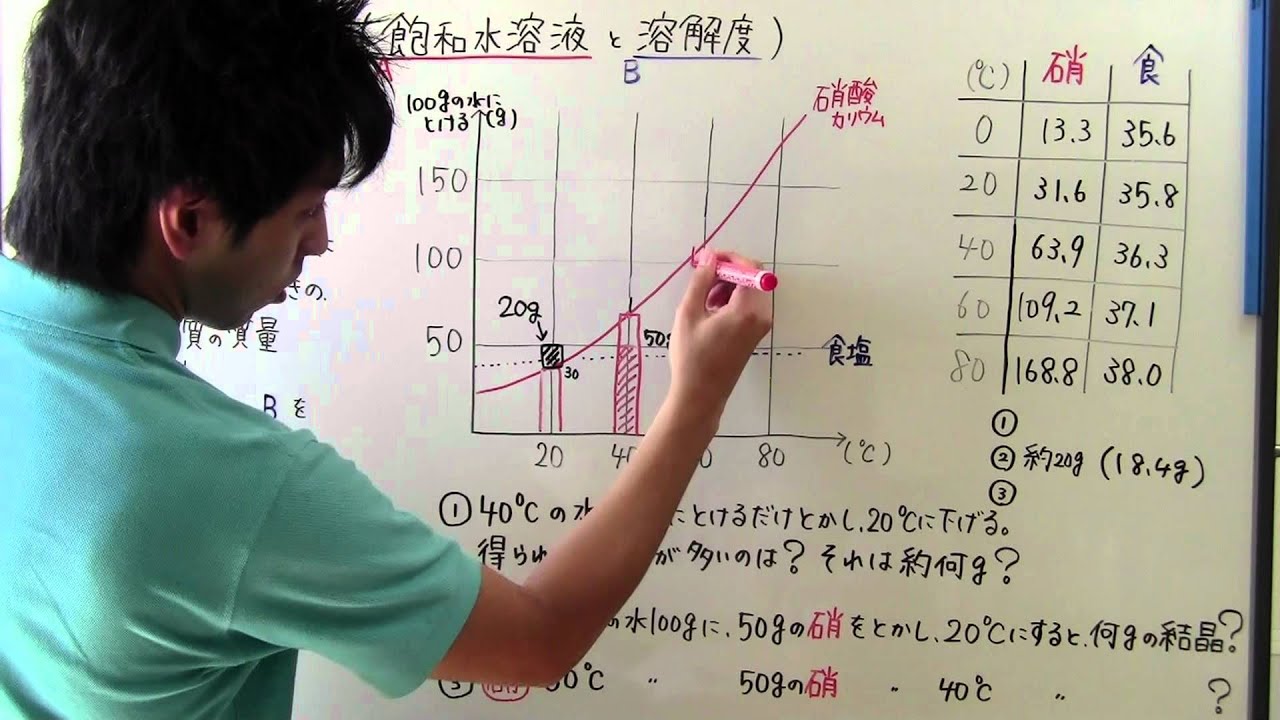
飽和溶液を冷却 して結晶が析出しても,溶媒の量は変化しません(無水物の場合)。 では結晶の析出量の計算について,問題を解いて考えてみましょう。 (考え方) まず,水100gでつくった70℃の飽和水溶液が30℃に冷却されたとき,何gの結晶が析出するかVideos you watch may be added to the TV's watch history and influence TV recommendations To avoid this, cancel and sign in to on your computer An公式の使い方は下にあるの沸点上昇度と凝固点降下度との組合せも出てくるので、そのときにまとめることにします。 質量モル濃度はあまり慣れていない単位なので少し練習しておきましょう。 例題1 水 300g に尿素 36g を溶かした溶液のの質量モル濃度を
溶液の質量g ×100 で表す。 w/v% は,質量体積パーセント濃度,若しくは質量容積パーセント濃度といい,分子が溶質 の質量 gで分母が溶液の体積mL の場合であり,w/v% = 溶質の質量g 溶液の体積mL ×100 で表す。 v/v% は,体積パーセント濃度といい, vol% という表し方もある。分子が溶質のとなり、真鍮試料溶液中にあった銅の質量は0214gと求められた。 結果から銅の質量は真鍮の質量の693%を占めていることが分かった。 また、亜鉛は真鍮の質量の297%を占めていた。 これは銅と亜鉛の割合が7:3の真鍮2)であることを確かめられた。 参考文献:1)三省堂 化学小辞典 第3版> 2 ②質量パーセント濃度の求め方 白枝先生 では、質量パーセント濃度はどうやって求めるのでしょうか? 先ほども言いましたが質量パーセント濃度は「 ある溶液中に溶けている溶質の割合 」です。 つまり、溶質の質量が溶液の質量のどれだけを示すのかを表すものになります。 それを




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく



化学 6回目授業 ブログ De 授業 21
溶質の質量 (g) ÷ 溶液の体積・容積 (ml) × 100 = 質量/体積パーセント濃度 %よって、この水溶液の質量は、体積1Lあたり質量は 「10g」 です。 質量パーセント濃度〔%〕= (溶質の質量〔g〕/水溶液の質量〔g〕)×100 溶液 の 質量 の 求め 方 はじめに ここでは溶液の濃度を表す単位である質量パーセント濃度モル濃度そして質量モル濃度の単位求め方についてまとめています 質量パーセント濃度 小学校や中学校で食塩水の濃度を求めてみましょうという問題を解いたのを記憶しれいる人も多いかと 質量




中学理科 計算問題 質量パーセント濃度の計算 Youtube



5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する
方程式を使う解き方 求めたい溶媒(水)の質量を x として解きましょう。 溶質が48g なので、 溶液は (x48)g です。 あとは、 「溶液 × 濃度 = 溶質」 の式で解きます。 「48gの食塩で15%の食塩水を作りたいなら、272g の水に溶かせばいい」 という答えが出ました。質量パーセント濃度 % =(溶質 g / 溶液 g)×10 水溶液の濃度(質量パーセント濃度):公式と求め方 水溶液の濃さは溶質の質量を水溶液の質量で割って100をかけて求めます。 参考 沸点上昇による分子量測定 モル沸点上昇 K b の溶媒 W g に, 1mol の質量が M 〔 g/mol 〕 (M の数値は分子量) の溶質 w g を溶かした時の溶液の沸点が,純溶媒より D t 〔℃〕だけ上昇したとすると,質量モル濃度 m は次式の様になる。 ,したがって, ,よって 例題 100g の二硫化炭素 CS 2 に 1




4 6 溶液の濃度 おのれー Note



5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する
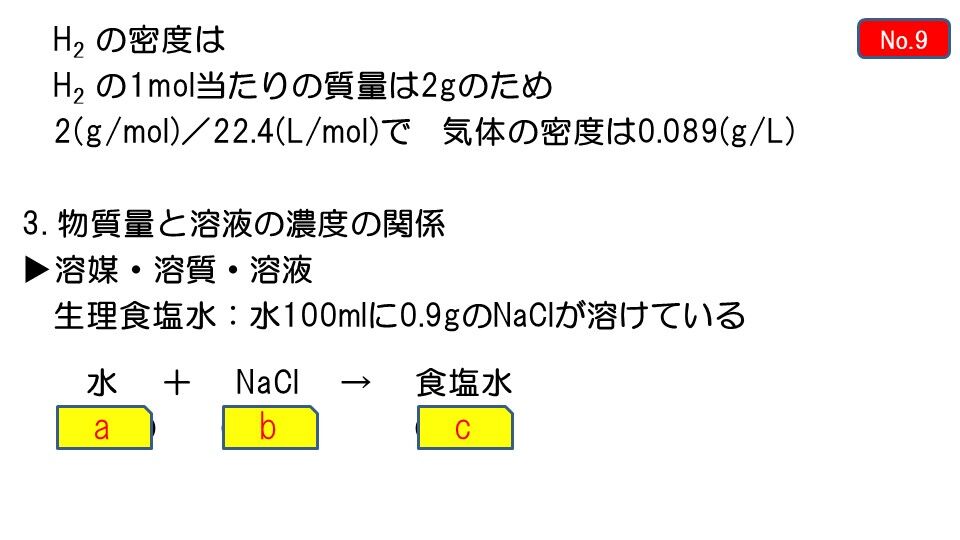
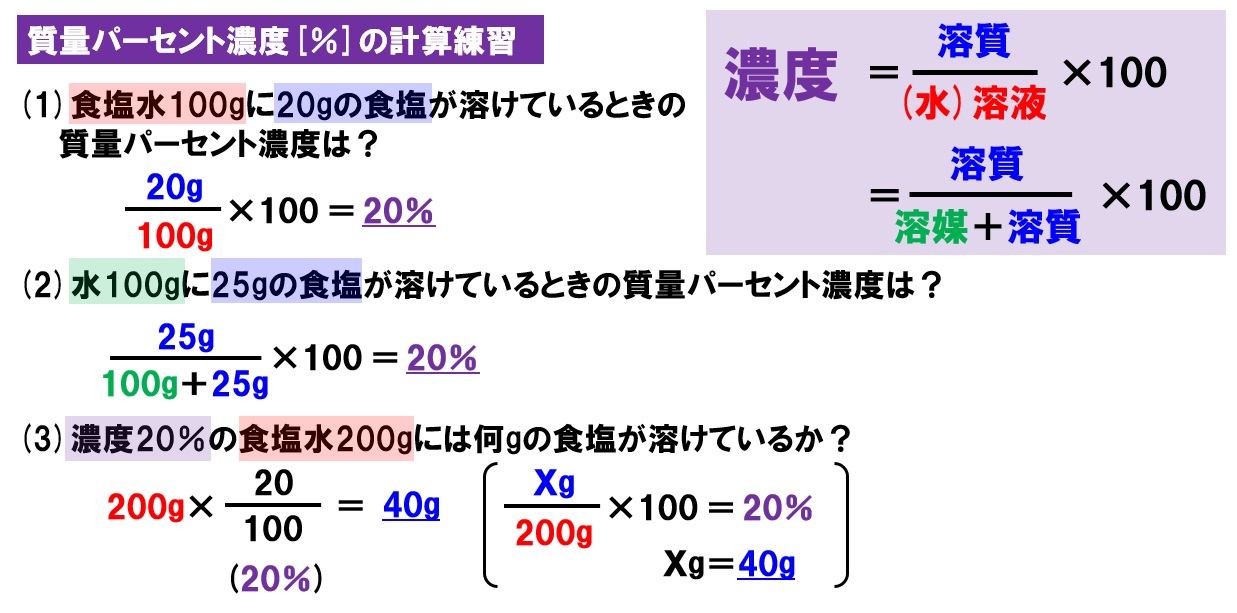
ホーム » 理科 » 化学 » 「濃度」の計算が苦手な方へ!元研究員がわかりやすく解説 問題2 gの食塩を400gの水に溶かしました。この食塩水の質量パーセント濃度を求めましょう。 解答 上の問題と違うのは溶媒(水)と溶質(食塩)の合計(=溶液)が400gなのか、溶媒(水)が400gなのはじめに 前回は溶液とはなんなのかについて説明しました。 今回は、溶液の濃度について学びましょう。 濃度の求め方 溶液には溶かした物質が同じものでも、濃度によってちがうものになります。 例えば、同じ塩水でも薄い塩水と濃い塩水がありますよね。 溶液の質量 = 溶質の質量 溶媒の質量 となります。 溶かしたものと溶けたものの合計した重さのことです。 これを式を使って表してみます。 重 要 濃度(%)=溶質の質量(g)÷ 溶液の質量(g)×100 $$濃度(%) = \frac{ 溶質の質量(g)}{溶液の質量(g)}×100$$ この式は濃度の求め方の




高校化学 質量モル濃度 映像授業のtry It トライイット




化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム
溶液の濃度の求め方!密度から求める方法も! トシニュース 密度18g/cm3、98%の濃硫酸のモル濃度を 求めなさい。(H2SO4=98) 溶液1Lの質量 は、18×1000g 98%濃硫酸なので、含まれる 硫酸の質量 は 18×1000×098=1764g 1molは98なので、1764/98=18mol 答えは 18mol まとめ 気体も粒子を持っているので固体溶液に溶けている物質の質量÷溶液の質量×100 で計算し、単位は「 % 」です。質量パーセント濃度が (溶質の質量g / 溶液の質量g) × 100 = 98% だったから、当てはめると、溶質は になる。(掛け算の計算が面倒なときは後回しにして、あとで約分しよう!)




1分でわかる質量パーセント濃度の公式や求め方 基本を登録者数95万人人気講師がわかりやすく解説 ページ 4 4 Study Z ドラゴン桜と学ぶwebマガジン




高校理論化学 溶液の濃度と調製 質量パーセント濃度 密度とモル濃度の単位換算 受験の月
Tom 18年9月6日 溶液の濃度表示(単位) T 溶液の濃度表示について 目次 (項目へとびます) 非表示 1 質量百分率 % 2 体積百分率 vol% 3 質量対容量百分率 w/v% 4 モル濃度 mol/L 5 質量モル濃度 mol/kgこんにちは!この記事を書いてるKenだよ。握りたいね。 中1の理科では、 質量パーセント濃度の求め方の公式 を勉強したよね?? 「公式は覚えられ「質量」と「重さ」は、何が違うんですか? 中1です。「密度」ってどういう意味ですか? 中1です。「溶質」「溶媒」「溶液」の違いは? 中1です。「濃度」の求め方が分かりません。 中1です。「入射角」「反射角」「屈折角」って?




質量パーセント濃度の計算問題集 応用編 Menon Network



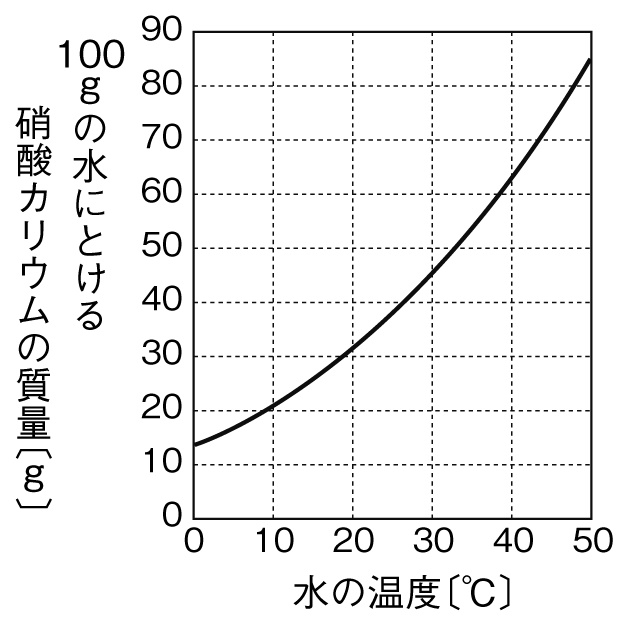
中1 理科 中1 34 飽和水溶液 溶解度 Youtube
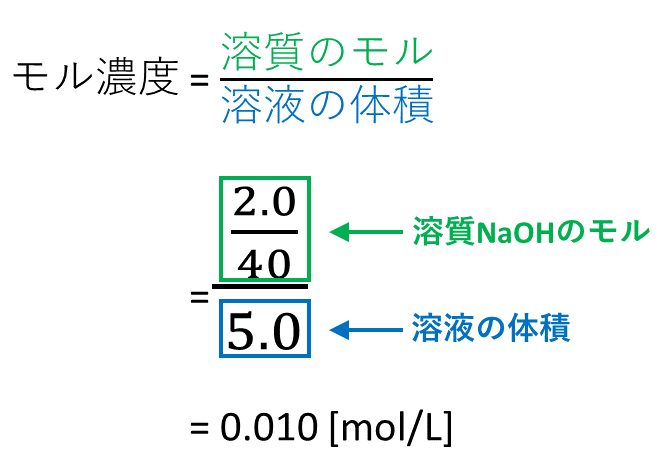
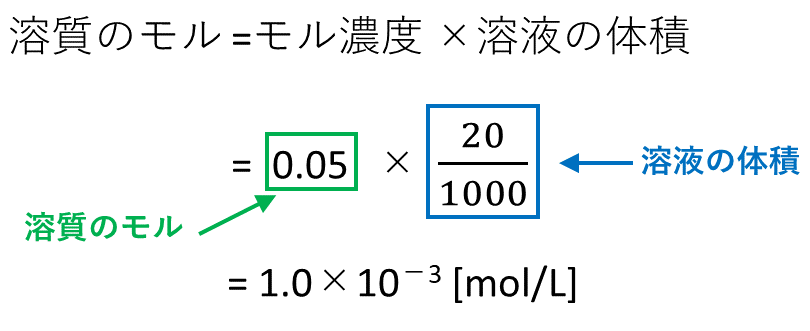
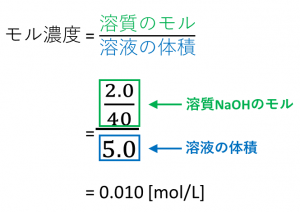
解答: (℃) 凝固点降下の公式を用いて式をたてる。 Δ T f = K f ・ m = 185 × 111 ( g) 111 ( g / m o l) × 3 600 1000 ( k g) = よって凝固点は (℃)となる。 分子に3をかけているのは、CaCl 2 が電離した結果、CaCl 2 1molがイオン3mol分(Ca 2 が1mol、Cl – が2mol)になるからである。 C a C l 2 → C a 2 2 C l −モル濃度の考え方:混合溶液の調製を例に モル濃度の計算方法がわかれば,いろいろな水溶液を自由自在に調製できるように なる.そこで今回は,「濃い濃度の保存液を適量取って混ぜて希釈して目的水溶液を 調製する」という場面を想定した計算問題を,段階的にマスターすることにしようする溶質もあり,溶液ではなく,溶媒の質量を基準にした方が便利な場合も ある.そのためにモル濃度とは別に質量モル濃度が定義されている. 例題 117 gのNaClを500 gの水に溶かした.このときのNaClの質量モル濃 度を求めよ.NaClのモル質量を585 g mol1と




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




中学1年生 理科 水溶液の性質 練習問題プリント 無料ダウンロード 印刷 ちびむすドリル 中学生
ですから2%の溶液をりたいなら 溶媒の質量を a 溶質の質量を b とすれば 密度ρ= b/(a+b)=1/(a/b1) となりますから所要の密度ρを得るには a/b=(1/ρ)1 で計算できる比率で混ぜればいいのです。リンゴの質量は卵の(3 5 )倍である. ↓ 卵1個が50gだったのでリンゴ1個の絶対質量は(4 250 )g. ↓ さきの卵15kgの山と同数個(5 30 )個のリンゴを集めると (6 250 )g×(7 30 )個=(8 7500 )g=(9 75 )kg ↓ 卵とリンゴ(10 30 )個どうしの質量の比は




溶液の質量パーセント濃度の求め方と比重を利用した計算問題



質量パーセント濃度 簡単な公式で覚えよう おときち副塾長 電脳空間学習塾かもん Youtube



50g15 0g Descubre Como Resolverlo En Qanda




中学理科 水溶液の濃度と飽和 溶解度 偏差値40プログラマー




質量パーセント濃度 塾の質問箱




解説を見ても分かりませんでした 詳しく教えてください Clear



モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine




理科 中1 27 質量パーセント濃度 Youtube
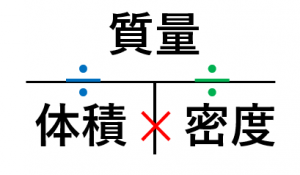



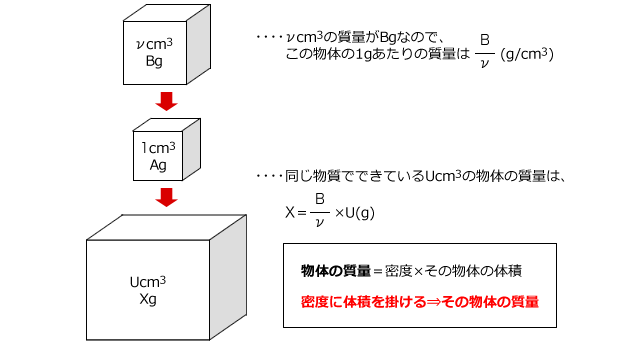
質量 密度 体積それぞれの求め方 具体例で学ぶ数学




質量パーセント濃度の計算問題集 基本編 Menon Network




質量パーセント濃度 モル濃度の変換方法を攻略しよう 化学 アイドル好きのホームページ
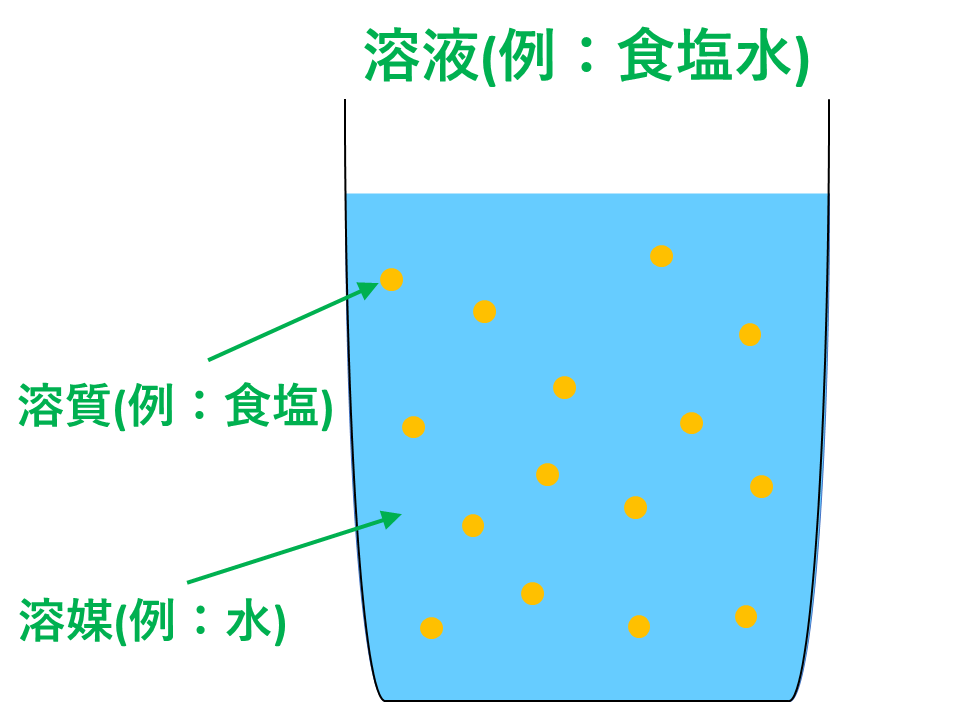



5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する
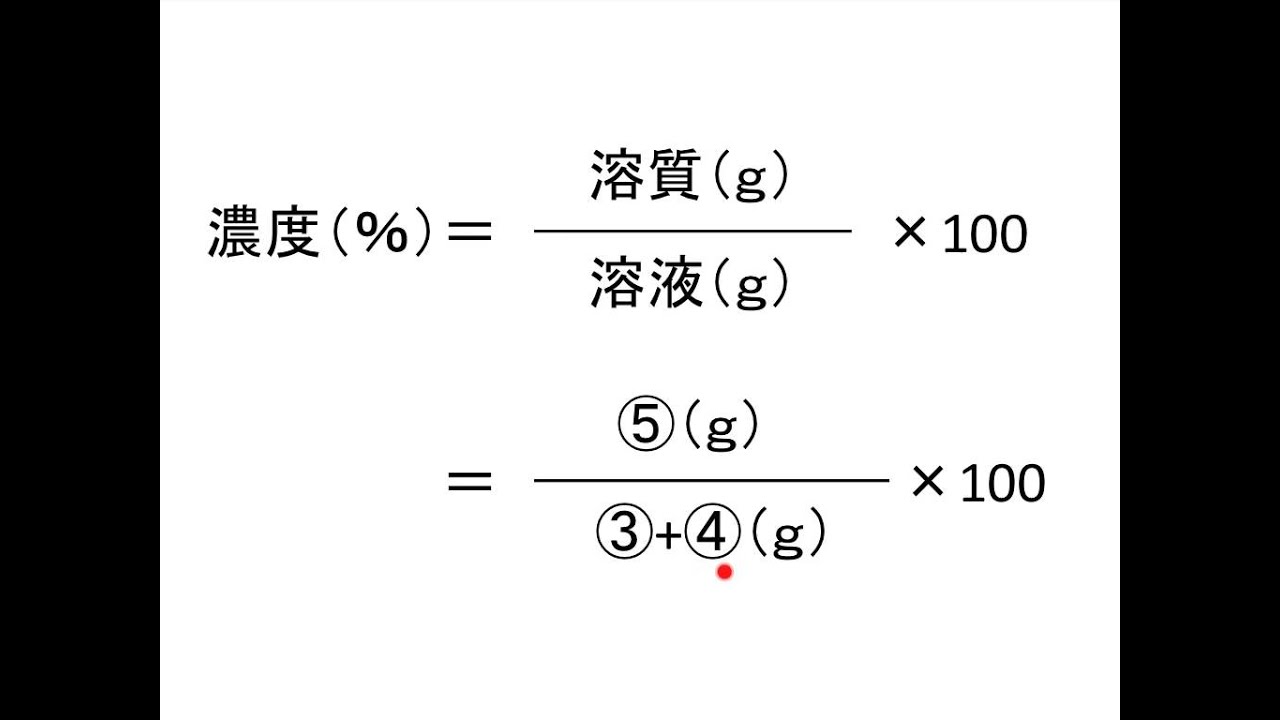



濃度の求め方 絵で覚えよう Youtube




高校化学基礎 質量パーセント濃度とは 映像授業のtry It トライイット




理科 テストによく出る 濃度の計算方法 家庭教師のやる気アシスト




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




質量パーセント濃度の計算問題集 基本編 Menon Network
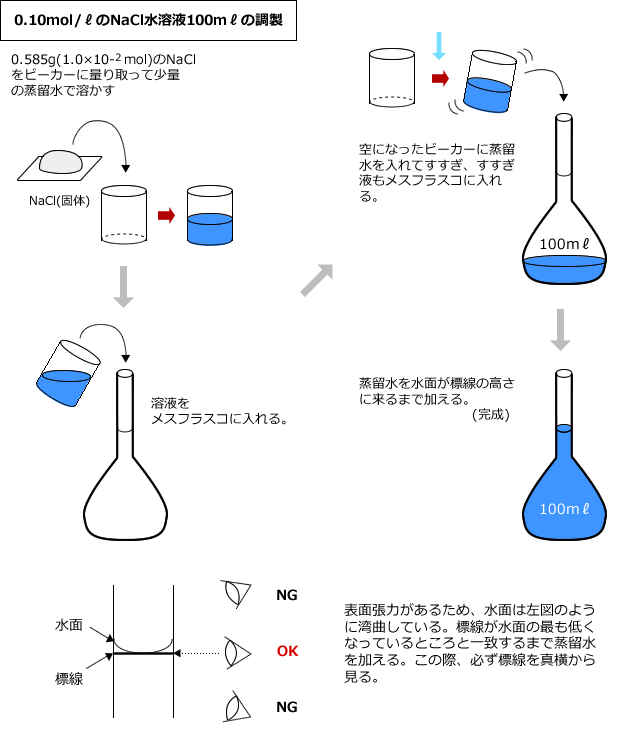



化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム
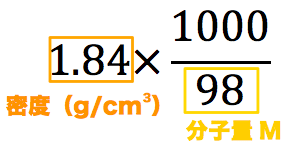



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




溶液の質量パーセント濃度の求め方と比重を利用した計算問題




4 6 溶液の濃度 おのれー Note




質量パーセント濃度の求め方 溶液 溶質 溶媒 の理解が勉強のポイント




高校化学基礎 質量パーセント濃度とは 映像授業のtry It トライイット




質量パーセント濃度の計算問題集 基本編 Menon Network



濃度の応用
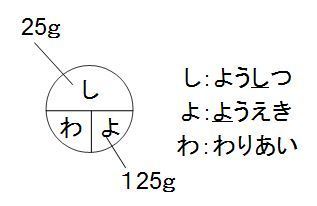



しわよ で覚える質量パーセント濃度 中学テスト 入試対策ノート




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




見にくくてすいません 化学の質量パーセント濃度計算で Clear




5分でわかる モル濃度 溶液1l中に溶質が何モル溶けている 元研究員がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン




溶媒1kgの中に溶質が何mol溶けているかを示す 質量モル濃度 を元研究員が解説 Study Z ドラゴン桜と学ぶwebマガジン



中1理科 水溶液と濃度 水溶液の性質と濃度計算 Pikuu




高校化学 質量モル濃度 映像授業のtry It トライイット




質量パーセント濃度に関する問題です 0 4がどこから出てきたのかわかりません Clear



1




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット




برچسب 質量パーセント濃度 در توییتر




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく



化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




高校理論化学 食酢中の酢酸のモル濃度と質量パーセント濃度 受験の月




4 6 溶液の濃度 おのれー Note
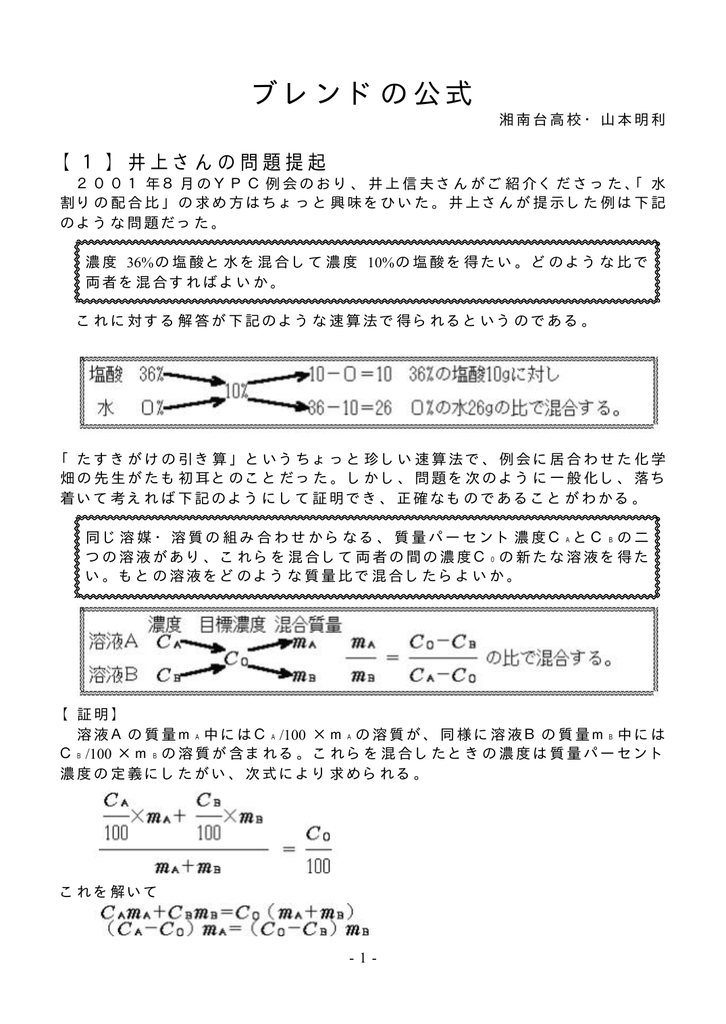



ブレンドの公式 Pdfファイル538kb



1
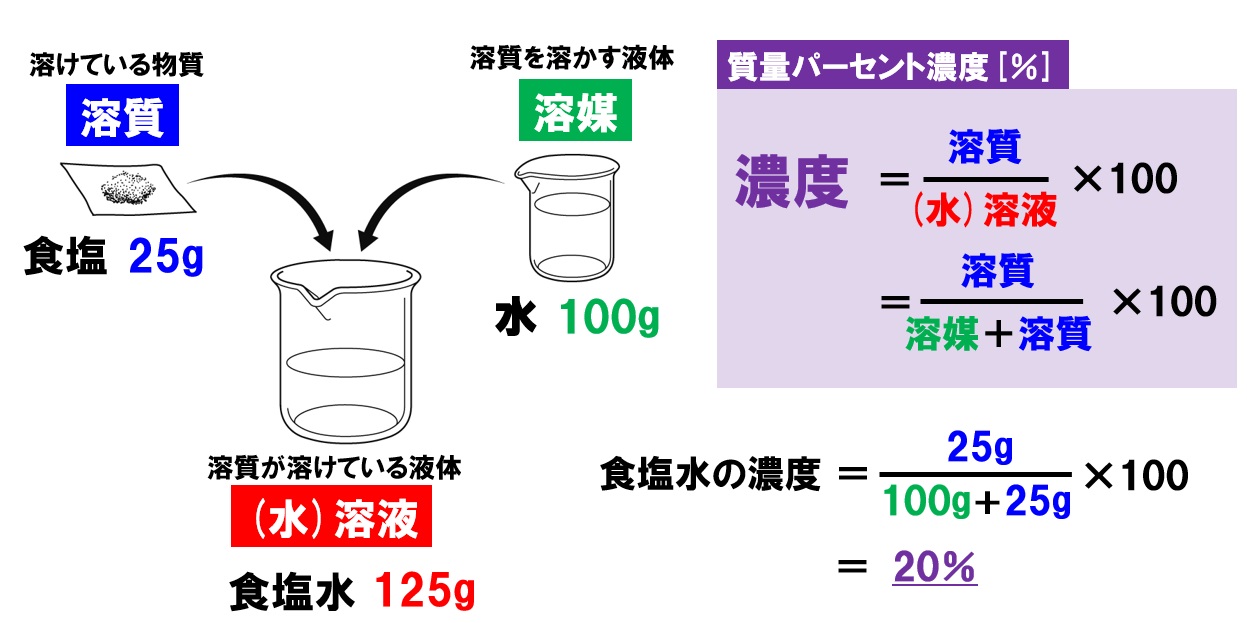



中1理科 水溶液と濃度 水溶液の性質と濃度計算 Pikuu



これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく




これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく




質量パーセント濃度の計算問題集 基本編 Menon Network




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




質量パーセント濃度の計算問題集 基本編 Menon Network




溶液の性質 水和水をもつ固体の溶解度の求め方を教えてください 化学 定期テスト対策サイト
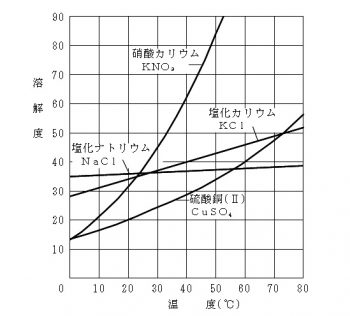



溶解度と温度変化による結晶析出量の計算方法と求め方



溶質を求める




中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu



1




Science 物質 溶解度と濃度 働きアリ
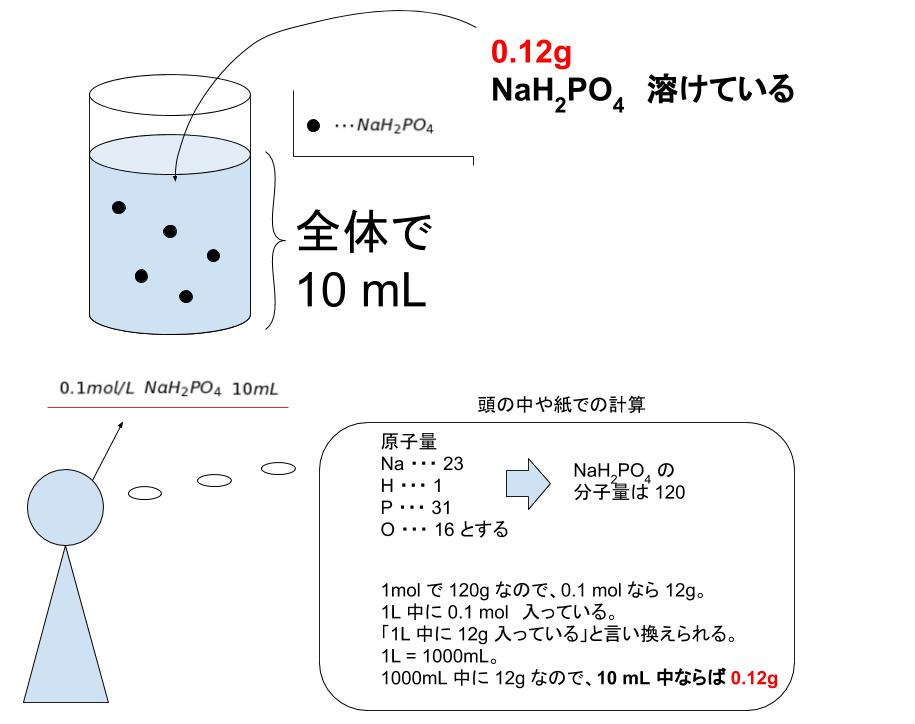



溶液の濃度計算 薬学 これでok




モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




この情報から 0 8溶液 1 5溶液 2 2溶液の質量モル濃度の求め方が わからない Clear




07溶液 モル濃度から質量モル濃度への単位変換 ポイント解説 4分 Youtube



中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu
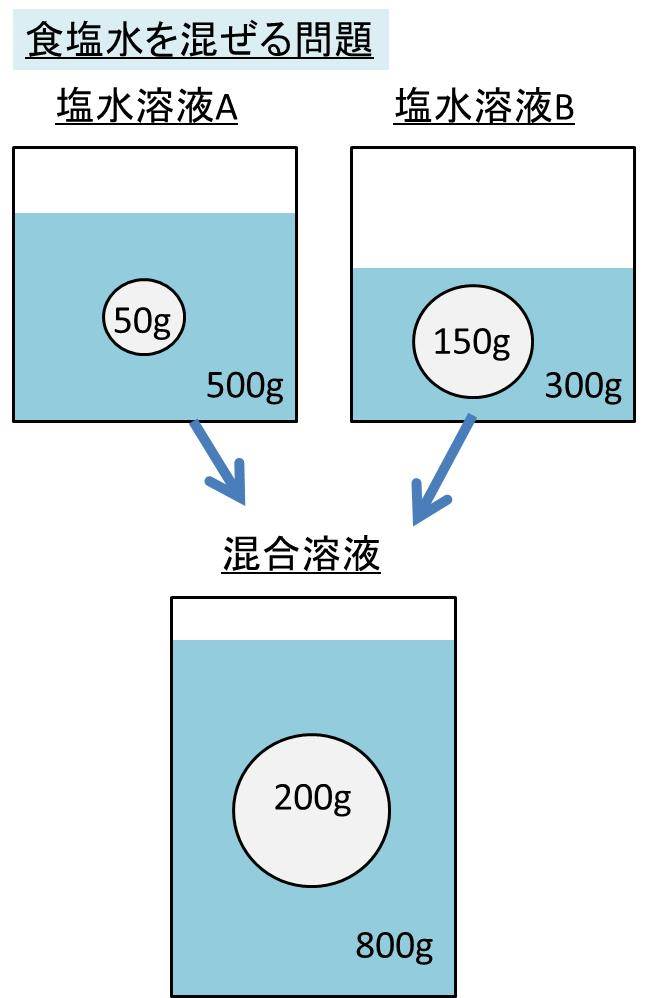



Spi 異なる濃度の食塩水を混ぜる問題の計算方法 濃度算




濃度のはなし 高校生向け モル濃度と質量モル濃度について 学習内容解説ブログ




これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット




濃度について 質量パーセント W W と質量体積パーセント W v 生涯学人 まなびと 楽しいサイエンス 暮らしはサイエンス 子供たち サイエンスを感じて




中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu




高校化学 質量と物質量 濃度の計算 オンライン無料塾 ターンナップ Youtube




4 6 溶液の濃度 おのれー Note
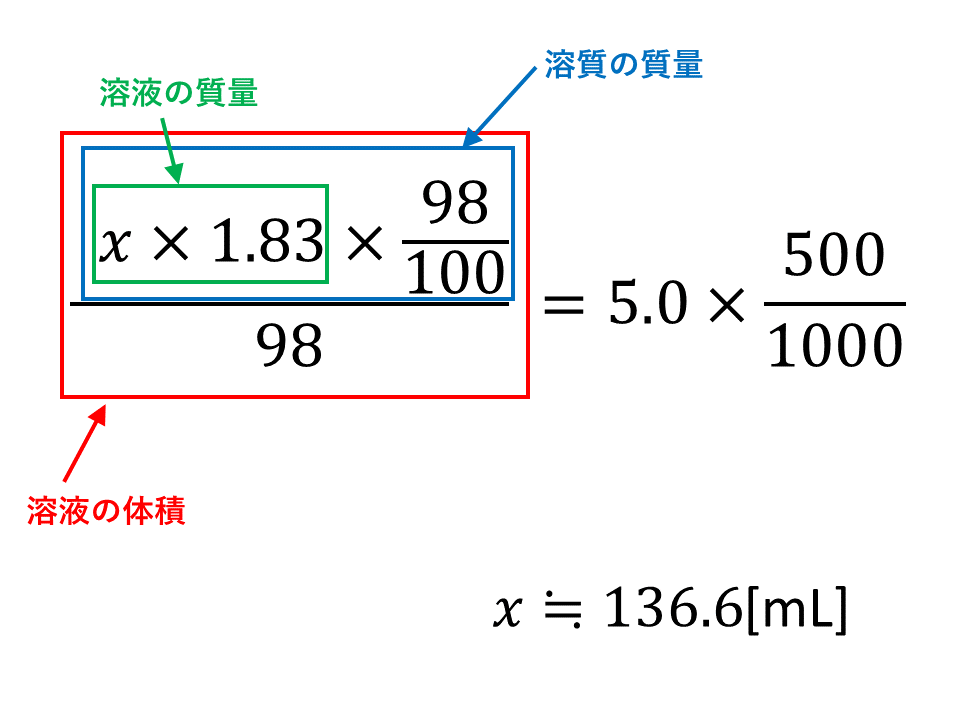



モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine
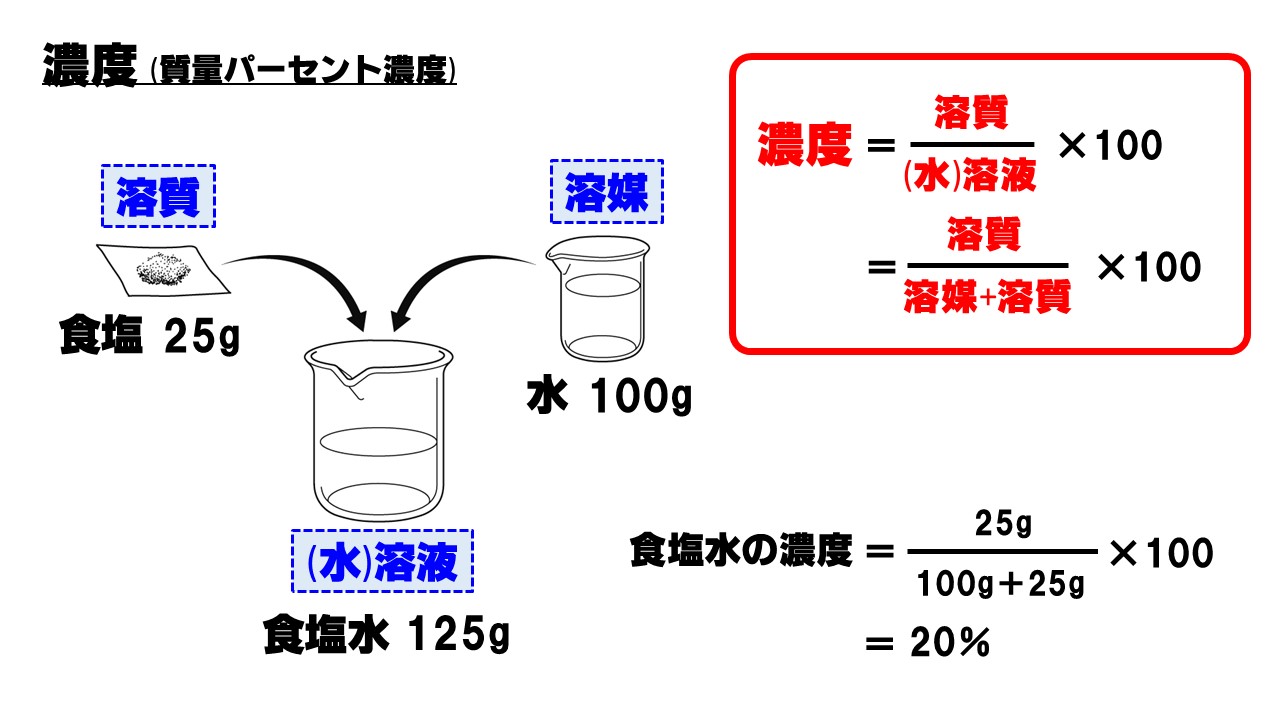



中1理科 濃度 質量パーセント濃度 のポイント Examee




高校生物基礎 腎臓のイヌリン濃縮率や原尿量などの計算問題の解き方 高校生物の学び舎
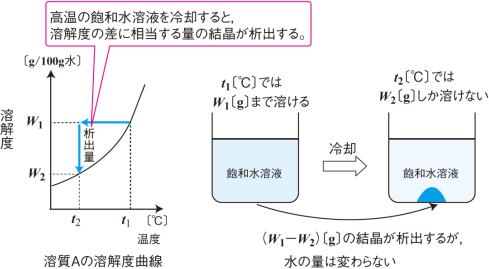



溶液の性質 飽和溶液を冷却したときの結晶の析出量の計算方法を教えてください 化学 定期テスト対策サイト
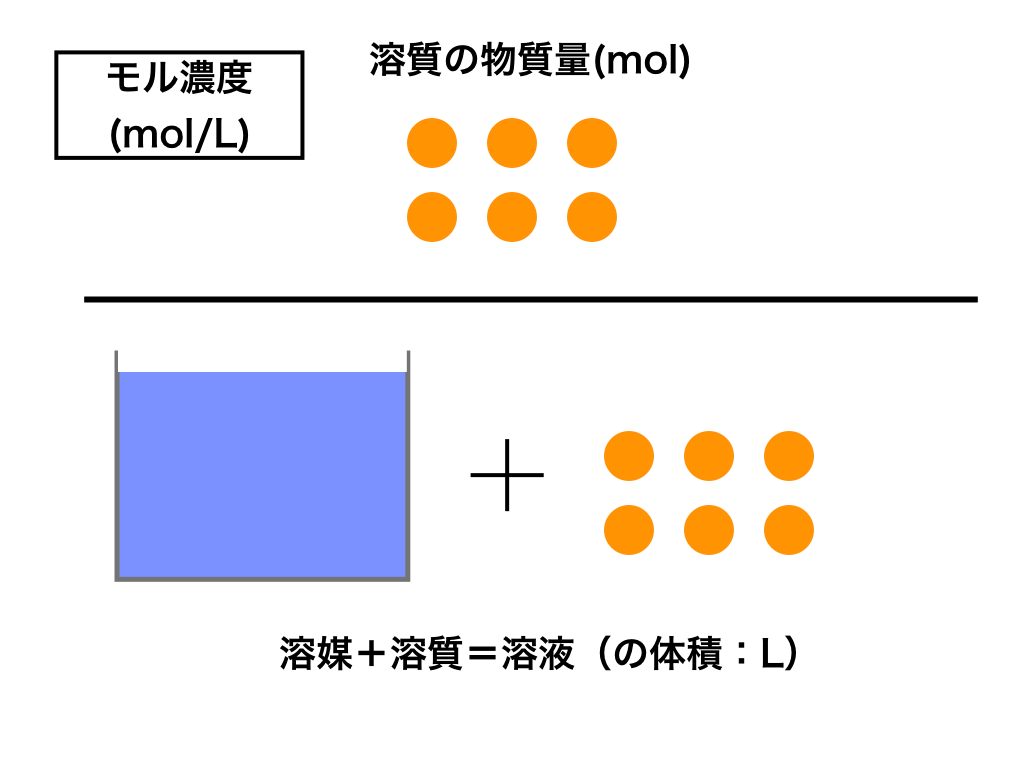



Mol濃度 質量パーセント濃度 質量モル濃度の相互変換の仕方のコツ




この問題の 4 の求め方を教えてください 答えは180gです Clear




溶液の濃度 無料で使える中学学習プリント
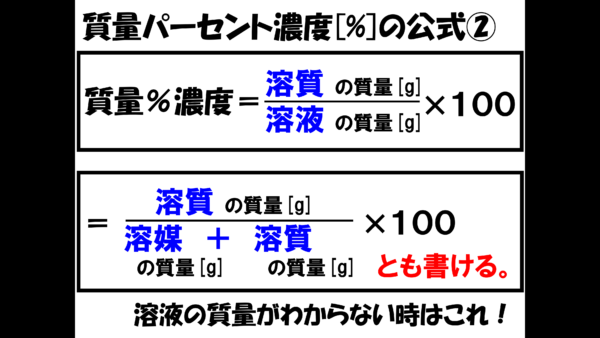



危険物資格取得のための高校化学no 1 濃度計算 F M サイエンスブログ




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




質量パーセント濃度の求め方とモル濃度の違い




モノマナビ研究所




برچسب 質量パーセント濃度 در توییتر



Mol濃度 質量パーセント濃度 質量モル濃度の相互変換の仕方のコツ




この解き方で解けないのはなぜですか Clear




8 を教えて下さい 比でやる求め方が分からないので お願いします Clear




これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく



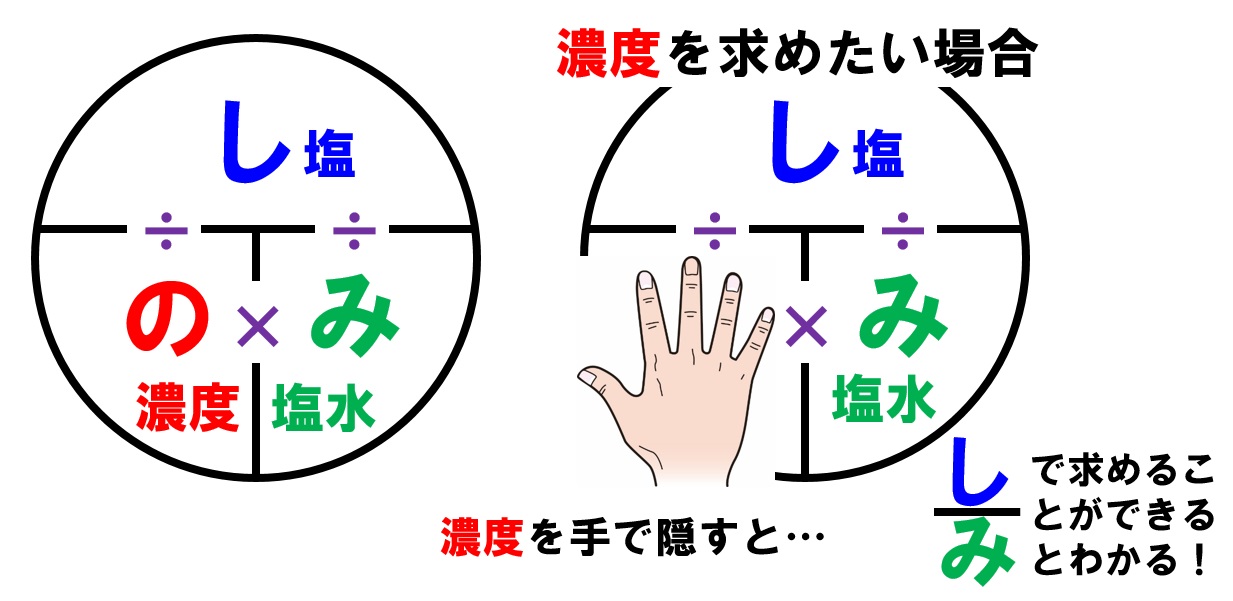
中1理解の 質量パーセント濃度 公式ですが く も わみ Yahoo 知恵袋



定期テスト対策問題 質量パーセント濃度の計算演習問題 Examee



Q Tbn And9gcsb1uq7n3ghpdmmm6bnifzarmojtjzs00fu7ldneg50py0pkw Usqp Cau




高校化学基礎 質量パーセント濃度とは 映像授業のtry It トライイット




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく



0 件のコメント:
コメントを投稿